한미약품 기술수출 9건 중 5번째 반환한미 외에도 국내사 다수 신약개발 쓴맛신약 프로젝트 실패 회사 존폐까지 거론실패 경험삼아 도전···좋은 결과로 이어져
한미약품은 마무리 단계에 접어든 에페글레나타이드의 글로벌 임상 3상을 완료하는 방안을 사노피와 협의하기로 했고 새로운 글로벌 파트너사를 찾겠다고 했지만 기술수출 계약파기에 대한 후유증은 상당하다.
신약개발은 성공하면 대박 실패하면 쪽박이라는 공식처럼 기업에 기회와 위기라는 상반된 작용을 한다. 대박의 신기루에 가려졌던 신약개발은 성공보다는 실패가 많았다.
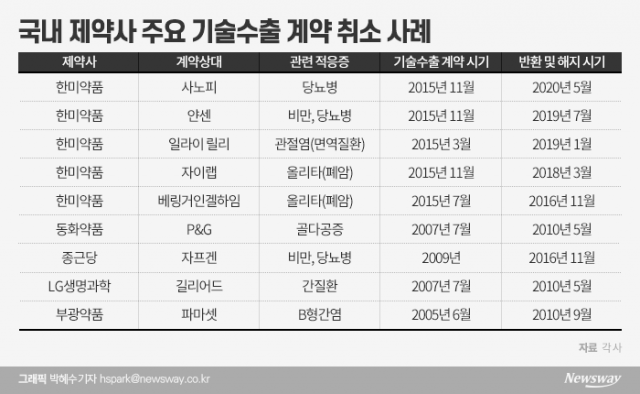
◇한미약품, 기술수출 9건 중 5건 반환 = 최근 한미약품은 파트너사 사노피가 당뇨 신약 ‘에페글레나타이드’의 권리를 반환하겠다는 의향을 통보하면서 이슈의 중심에 섰다. 다국적 제약사 사노피에 약 5조원(39억유로)에 달하는 당뇨병 신약 에페글레나타이드 기술수출 한 지 5년만이다.
이 회사는 신약개발과 관련해 지난 2011년 이후 지금까지 총 9건의 기술수출 계약을 맺었다. 이 중 5건은 해지됐거나 해지를 앞두고 있다.
2016년 독일 제약사 베링거인겔하임이 폐암 신약 올리타의 기술이전 계약을 해지했으며, 중국 제약사 자이랩도 2018년 3월 올리타 기술이전 계약을 파기했다. 2019년 1월에는 일라이릴리가 BTK 억제제 기술 사용 권리를 반환했고 같은 해 7월에는 얀센이 비만·당뇨신약 기술권리를 반환한 바 있다.
◇주요 제약사 기술수출 반환 빈번 = 기술이전에 성공했으나 반환되거나 임상에 실패한 일은 국내 굴지의 제약사도 빈번하다.
동화약품이 지난 2007년 미국 P&G사와 맺은 골다공증치료제 기술수출(5억 달러 규모)은 글로벌 금융위기를 겪은 후 2009년 워너칠콧사에 인수된 P&G전문의약품 사업부가 개발 철회를 밝히면서 파기됐다.
종근당 역시 신약개발 기술수출에 뼈아픈 경험이 있다. 이 회사는 지난 2009년 미국계 제약사 자프겐에 비만치료제 벨로라닙을 기술수출했지만 2016년 임상시험이 중단된 바 있다. 임상시험 과정에서 혈전증으로 인해 사망자가 발생한 것이 주된 이유로 알려졌다.
이에 앞서 지난 2007년 LG생명과학(현 LG화학)이 미국 제약사 길리어드에 자체개발한 차세대 간질환 치료제 카스파제 저해제 기술수출도 임상시험 과정에서 일부 부작용이 나타나며 계약이 파기됐다.
부광약품도 지난 2005년 미국 파마셋과 B형간염 치료제 클레부딘 기술수출 계약을 맺었지만, 제품 안전성을 문제로 임상을 중단하며 계약을 해지했다. 당시 부광약품은 파마셋이 연구비용을 감당할 수 없어 연구를 중단했다고 주장한 바 있다.
◇신약개발 성공했지만 허가 자진취소 하기도 = 이와는 별개로 국내에서 허가를 받았으나 개발을 중단하거나 허가를 자진 취소한 사례도 있다.
한미약품은 2018년 첫 번째 신약으로 허가받은 올리타의 개발 중단이 대표적인 사례다. 이 신약은 2016년 5월 식품의약품안전처로부터 임상 3상 시험을 전제로 조건부 허가를 받았다. 27번째 국산 신약이었다.
제약업계에서는 앞선 국산 신약과는 달리 글로벌 시장에서도 충분히 통할 것으로 기대했으나 베링거인겔하임의 타그리소가 세계 40여개국에서 판매되는 등 경쟁 약품의 상업화로 인해 임상 완주를 스스로 포기했다.
CJ헬스케어의 녹농균 백신 ‘슈도박신’, 동화약품의 간암 치료제 ‘밀리칸’ 등도 시장 경쟁력이 없다는 이유로 허가를 자진 취소했다.
◇신약개발 중단은 회사 존폐 기로 내몰아 = 신약개발 과정에서 임상이 중단되는 것은 회사의 존폐와도 맥이 닿아있다.
신약개발은 통상적으로 일반인을 대상으로 안전성 여부를 시험하는 임상 1상과 환자를 대상으로 약효 유효성을 검사하는 임상 2상, 마지막으로 대규모 환자를 대상으로 약효와 부작용을 장기적으로 평가하는 임상 3상으로 나뉜다.
미국 식품의약국(FDA)에 따르면 임상 단계별 성공률은 63%(임상 1상), 31%(임상 2상), 58%(임상 3상) 순으로 임상 2상이 가장 낮다.
임상 1상과 2상을 성공하더라도 3상은 기본적으로 1000명 이상의 환자를 모집해야 하고 상황에 따라 인종별로 나눠야 한다. 천문학적인 비용과 시간이 소요됨은 물론 예상치 못한 변수도 많이 일어난다.
제약업계는 신약개발에 보통 10~15년이라는 시간과 평균 1조원이 넘는 비용이 소요된다고 말한다. 때문에 국내 제약사의 신약개발 중단은 단순히 한 신약개발 프로젝트가 끝나는 것이 아니라 기업의 존폐 기로에 까지 놓이게 되는 경우도 존재한다.
실제 신라젠은 2년 전까지만 해도 시총이 8조~9조원대를 넘나들며 코스닥 순위 2위에 오르기도 했다.
투자자들은 신라젠이 개발 중인 면역항암제 후보물질 펙사벡에 대한 큰 기대를 가졌지만 지난해 8월 미국 데이터모니터링위원회(DMC)가 펙사벡의 미국 임상 3상 중단을 권고하면서 주가는 수직 낙하했다. 한때 15만원대까지 치솟았던 주가는 현재 1만2100원에 거래가 정지된 상태다.
반면, 미국 제약사 길리어드는 작은 벤처기업으로 출발했지만 신종플루 치료제 타미플루, B형간염 바이러스 치료제 비리어드와 C형간염 치료제 소발디, 하보니를 시장에 내놓으면서 명실상부한 글로벌제약사로 올라섰다.
◇신약개발 제약사, 제2의 길리어드 도전 이어져 = 현재 수많은 국내 제약바이오기업들이 제2의 길리어드를 꿈꾸며 신약개발 도전을 멈추지 않고 있다.
한국제약바이오협회가 국내 제약 기업 100개사 대상으로 실시한 신약 파이프라인 관련 설문조사 결과 개발되고 있거나(573개) 개발 예정(380개)인 신약 파이프라인은 953개로 조사됐다.
업계 관계자는 “한미약품의 기술수출 반환, 신라젠 펙사벡 임상 실패, 신약 허가취소 등의 악재는 노력을 하는 도중에 시행착오를 겪은 것”이라며 “이를 경험 삼아 계속 도전한다면 머지않아 국내에서도 글로벌 신약개발의 성과가 나올 여지가 많다”고 말했다.

뉴스웨이 이한울 기자
han22@newsway.co.kr
<저작권자 © 온라인 경제미디어 뉴스웨이 · 무단 전재 및 재배포 금지>




















댓글